한국 이어 승인… 내년 美 공략
셀트리온·동아ST도 허가 신청
바이오시밀러 시장 경쟁 치열
23일 삼성바이오에피스는 스텔라라의 바이오시밀러로 개발한 ‘피즈치바’(프로젝트명 SB17)가 유럽연합 집행위원회(EC)로부터 품목허가를 받았다고 밝혔다. 국내에선 지난 11일 식품의약품안전처로부터 품목허가를 받은 제품이다. 피즈치바는 미국 얀센이 개발한 의약품 ‘스텔라라’의 바이오시밀러다. 판상 건선, 크론병, 궤양성 대장염 등에 처방되는 자가면역질환 치료제다. 스텔라라는 지난해 매출 108억 5800만 달러(약 14조 9568억원)로 글로벌 의약품 매출 순위 9위인 ‘블록버스터’급 의약품이다.
바이오시밀러는 오리지널 의약품과 안전성과 효능면에서 차이가 없지만 가격은 30% 이상 낮은 것이 특징이다. 오리지널 의약품의 특허가 만료되는 시점에 바이오시밀러가 시장에 진출하면 해당 의약품의 수요를 흡수할 수 있다. 스텔라라의 물질 특허는 국내에선 지난해 7월, 미국에선 지난해 9월에 만료됐다. 유럽에선 올 7월 만료 예정이다. 많은 업체들이 스텔라라의 바이오시밀러를 개발해 경쟁하고 있는 이유다.
삼성바이오에피스는 유럽 시장에서 7종의 바이오시밀러 제품을 상업화했다. 회사 측은 “피즈치바의 유럽 허가로 기존 자가면역질환 치료제 3종에 더해 치료제 포트폴리오를 확장했다”고 설명했다.
거대 시장인 미국에선 빠르면 내년 2월 출시가 가능할 전망이다. 스텔라라의 매출 가운데 미국 매출(69억 6600만 달러)이 64%를 차지한다. 삼성바이오에피스는 미국 당국에 이미 품목허가를 신청했으며 얀센의 모회사인 ‘존슨앤드존슨’과의 특허 합의를 통해 내년 2월 제품 출시를 모색하는 것으로 알려졌다. 바이오시밀러 업체들은 시장 진입 이전 오리지널 제약사와 합의하는 것이 일반적이다.
셀트리온과 동아ST도 스텔라라의 바이오시밀러를 준비 중이다. 두 회사 모두 지난해 미국과 유럽에 품목허가를 신청했다. 셀트리온은 이르면 내년 3월 미국 출시를 목표로 한다. 김민영 동아ST 사장은 지난달 주주총회에서 “올해 하반기 유럽 출시 및 내년 상반기 미국 출시 예정”이라고 밝혔다. 미국에서 암젠, 알보텍은 이미 바이오시밀러의 품목허가를 받았다.
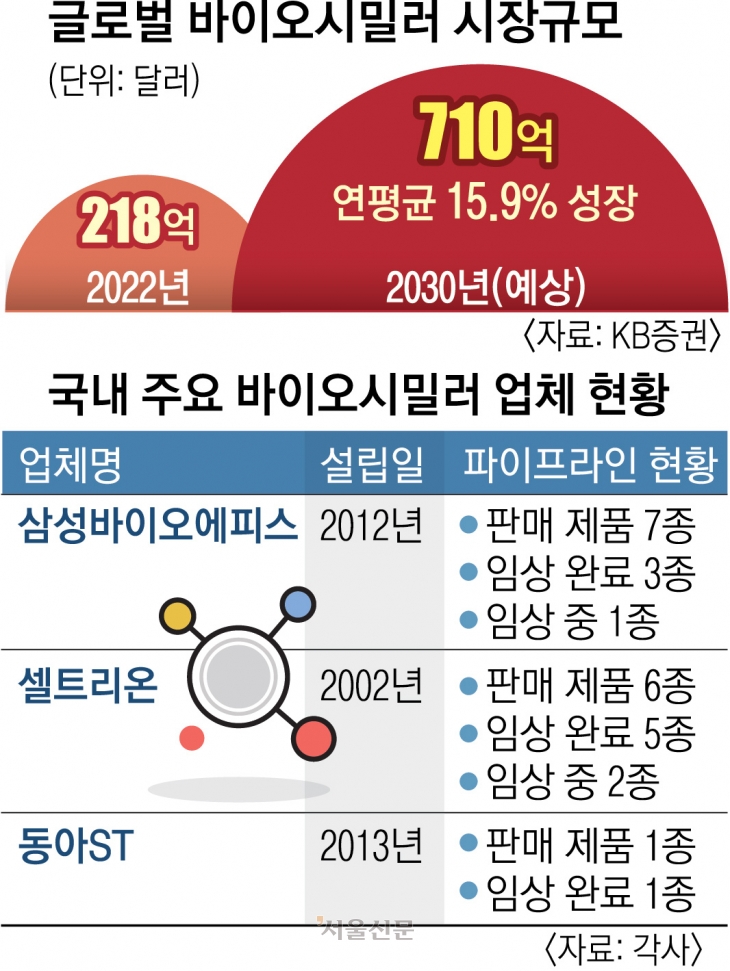
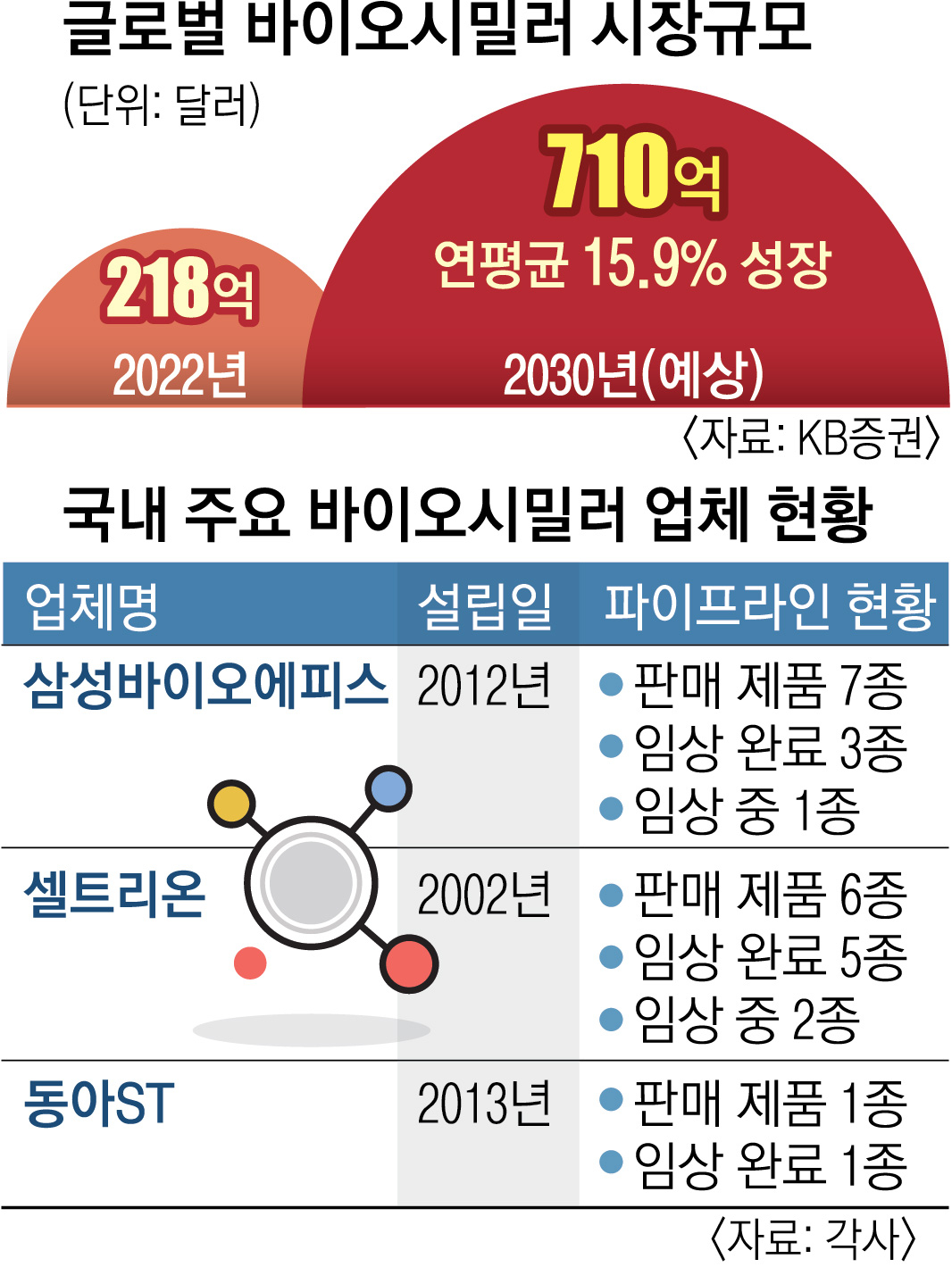
바이오시밀러 시장은 커질 수밖에 없다. 오리지널 약 대비 저렴하기에 정부의 의료재정지출 부담을 줄이는 데 도움이 되기 때문이다. 미국 바이든 정부는 인플레이션 감축법안(IRA)을 통해 바이오시밀러 사용을 유도하고 있다. KB증권에 따르면 글로벌 바이오시밀러 시장은 2022년 218억 달러(30조 404억원)에서 연평균 15.9% 성장해 2030년엔 710억 달러(97조 8380억원)로 확대될 전망이다. 이미 바이오시밀러는 오리지널 의약품을 빠르게 대체하고 있다. 지난해 8월 기준 미국 내 자가면역질환제 ‘레미케이드’와 항암제 ‘허셉틴’의 바이오시밀러 점유율은 각각 40%, 79%에 이른다.
2024-04-24 18면







































